No encuentro una palabra que pueda definir mejor los próximos doce meses que nos esperan a todos los comprados en este precio, en el cual, algunos llevamos años. Unos apostados desde el origen de su posición inicial, impertérritos ante cualquier eventualidad habida, que ¡vive Dios, si las ha habido!. Otros, con el permiso de ustedes, mas «culo-inquietos», mas sensibles a esas eventualidades, mas temerosos, o quizás mas jugadores de fortuna. Pero todos convencidos de estar ante un caballo ganador.
Hemos vivido dentro de este valor, tiempos, periodos o épocas, que podría definir como, de pasión, decepcionantes, frustrantes, de esperanza, de confianza, etc, y lo que nos queda por delante, ¡mamma mía!.
Recientemente leí que en China, elevaban el nivel de alerta por contagio ante el virus H7N9, y claro uno piensa, desea incluso que eso no vaya a mayores, como es lógico. Pero por otro lado, caso de ir, ahí estaría preparada «nuestra empresa», con los deberes bien hechos, como todos ustedes saben.

Hay quienes siguen afirmando que el ébola todavía no se puede dar por erradicado, tal como leí recientemente, sobre el caso de un adolescente muerto en Liberia el pasado mes de noviembre. Según esa noticia publicada en El Mundo el pasado reciente 24 de noviembre de 2015 (¡apenas hace seis semanas!), el padre y el hermano del fallecido también dieron positivo por el virus en los primeros análisis y las autoridades habían identificado al menos a 160 personas que podrían estar también contagiadas por haber estado en contacto con la víctima. De momento la prensa mundial hace mutis por el foro sobre el asunto, pareciendo que mientras ningún afectado nos toque de cerca a occidente, ¡aquí no pasa nada!. Esperemos que así sea, pero si pasa, Ahí estaría «nuestra empresa» con los deberes ¡por supuesto!, bien hechos.
Cada año, la gripe como temible enfermedad infecciosa que es, causa a nivel global una verdadera epidemia, con focos locales de auténtica pandemia. Como ustedes saben y conocen, sus síntomas van desde leves a incluso mortales. Estos últimos en individuos o poblaciones mas susceptibles, como niños, adultos mayores o personas afectadas de otras enfermedades colaterales, como alergia, asma, o cualquier otro tipo de enfermedad respiratoria. La carga que deben soportar los sistemas de salud de todo el mundo ante los diversos tipos de virus de la influenza (H1N1, H3N2, etc…) es tremenda tanto en monto económico, como en el que es aún mas importante, como es el de vidas humanas, estimadas en mas de un millón de muertes por año. Según diversos estudios, se estima que anualmente sufren los ataques del virus, un 10.50% de las personas adultas y entre un 20 y un 30% de los jóvenes y niños.
Como ustedes también son sabedores, nada tiene que ver la actual técnica basada en el cultivo del huevo, usada para la obtención de las vacunas anuales usadas en los programas de vacunacion a nivel mundial, en cuanto a velocidad de fabricación, con la técnica usada por «nuestra empresa», basada en la tecnología VLP. Tecnología que a través de nanopartículas recombinantes (explicado en el vídeo adjunto) y la ídem del adyuvante Matrix ™, son la base de toda una innovación que en las fases clínicas realizadas hasta ahora, ha demostrado mejorar de modo espectacular la respuesta inmune y la protección contra esta enfermedad estacional, contra la amenaza de sus patógenos infecciosos y su potencial pandémico. Tecnología infinitamente mas rápida en el desarrollo desde el primer trabajo con la primera muestra del virus, hasta su puesta en circulación en forma de vacuna para uso general. Con la importancia que esto tiene cuando estamos hablando de un virus con una alucinante capacidad para mutar.
Imaginen si este programa será importante, que cuenta con la contribución para su desarrollo de los fondos BARDA del Gobierno Federal Americano.
Y si ya nos ponemos a hablar de la joya de la corona de «nuestra empresa», que es el programa RSV, podría estar aquí hasta mañana escribiendo sin parar. Sobre esta enfermedad, sus síntomas, identificación, tratamientos, etc, les recuerdo, incluso recomiendo, a todos, pero sobre todo, a aquellos que no tengan muy claro de que hablamos, lean o refresquen esta entrada o post que dediqué al asunto, en este su blog, sobre el VIRUS RESPIRATORIO SINCITIAL..
A modo de resumen con grandes números, les cuento: Esta enfermedad es la causa número UNO de hospitalización en USA, para niños de entre 0 y 12 meses de vida. Siendo así mismo a nivel mundial una importante causa de morbilidad y mortalidad infantil. Las estimaciones actuales indican que el RSV es el responsable de más de 30 millones de nuevas infecciones respiratorias anuales y la principal causante de entre 150.000 y 200.000 muertes en niños menores de cinco años de edad. En los EE.UU., casi todos los niños (92%) se infectan con el RSV antes de los dos años de edad; Se asocia o relaciona con un 20% de las hospitalizaciones y otro tanto por ciento idéntico de las visitas a especialistas en niños menores de 3 años. Además se estima que entre 11 y 17.000 personas adultas, mueren cada año en los EE.UU., por la infección con RSV o sus complicaciones respiratorias derivadas. Se calcula que otras 180.000 personas, son hospitalizadas en USA por síntomas respiratorios graves, derivados o causados por el RSV. La Organización Mundial de la Salud, estima de manera oficial, que la morbilidad por RSV a nivel mundial y anual, se eleva a 64 millones de casos.(RSV_Vaccine_Timeline_FINAL).
Eso son grandes números, reales, pero grandes y tremendos números. Novavax está desarrollando una vacuna, en la actualidad en fase III, que cubriría a tres tipos de poblaciones: Los adultos mayores, los bebés (aquellos que reciben protección a través de los anticuerpos transferidos por sus madres en el útero, que serían inmunizados durante el último trimestre del embarazo), y por último toda la población pediátrica. Para la segunda de estas poblaciones, y después de los excelentes resultados obtenidos en sus dos primeras fases de estudios clínicos, incluyendo la seguridad, cuenta con importantes fondos de la Fundación de Bill y Melinda Gates (…ya saben fundadores de Microsoft Corporation).
¿Alguno de ustedes es capaz de imaginar otros grandes números?. ¿Aquellos que darían el verdadero valor de esta empresa llegado el momento?. ¿Los mismos que determinarían el sideral nivel de cotización para su precio, caso de (llegado el momento), seguir viajando sola o con compañía, o aquel nivel que vendría determinado por el resultado de dividir el precio ofertado por la compra de toda «nuestra empresa» entre el número de sus acciones?. Un servidor de ustedes se considera incapaz de ello.
Llegados a este punto, casi que solo me queda recordar a ustedes, que uno ha escrito a lo largo de estos años, «tan solo», y con esta que ustedes con tanto esfuerzo están leyendo, ¡¡ 32 !!. Y son todas y cada una de estas que pueden consultar, refrescar, etc… aquí.
Solo me queda decirles, no recuerdo si se lo dije antes, que están ustedes ante un precio, un valor, una empresa, que hará historia, y que se situará dentro en los primeros lugares de un hipotético ranking, de entre aquellas pharmas que lograron los mas increíbles logros y avances médicos para la humanidad.
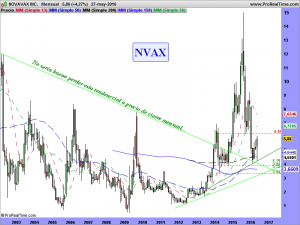
Su cotización, en la actualidad, no refleja el verdadero valor de la compañía, pero hemos de recordar que aún «no tenemos» nada en el mercado, nada que haga dinero y dé solvencia o solidez a un balance financiero, y eso es importante. Pero llegará, y lo hará muy pronto, mas pronto de lo que alguno de ustedes cree. Pero no me anden pendiente del reloj ni del calendario. Si ustedes después de leer esta entrada, de informarse en todos los lugares a donde fueron conducidos por los diversos enlaces, mas lo que puedan haber «brujuleado» por otros lares, aún tienen que mirar el calendario, ¡mal asunto!; Si aún no están convencidos del potencial que hay detrás de esta empresa, ni lo duden, ¡no es para ustedes!. Sigan buscando que el Nasdaq y otros mercados de cualquier otra parte del mundo, tienen miles y miles de otros valores. ¡Alguno encontrarán!.
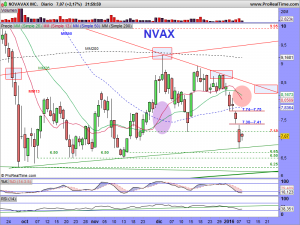
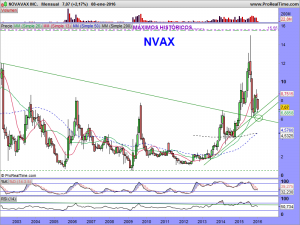
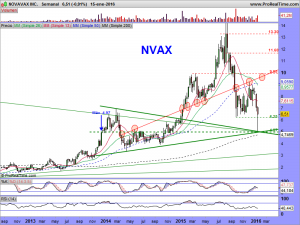
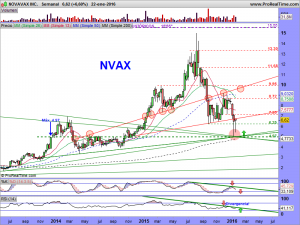
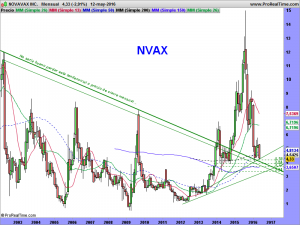
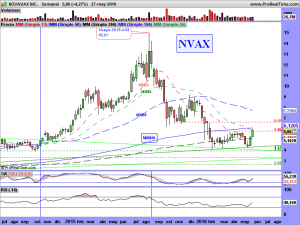
La parte técnica y sus gráficos, se los dejaré al cierre del mercado, dentro de un rato, o a lo largo del fin de semana, en el caso que nos ocupa, son lo menos importante ahora mismo. Son incluso muy contradictorios. El mensual da miedo, el semanal ¿qué quieren que les cuente?. Ambos apuntan a una sola dirección y esa es el nivel delimitado por la alcista de largo. De encaminarse hacia ella, habría que rezar para que la respetara. La fuerza nos la dará su lado fundamental. Necesitamos ese lado como el comer para que el lado técnico se arregle. Si los mercados no se arreglaran y sufrieran una importante corrección, solo se salvarían las empresas que pudieran ser sostenidas por su lado fundamental. «Nuestra empresa» tiene por ese lado mas potencial que una gran mayoría de las demás, pero hemos de recordar una cosa, de momento, ¡solo tenemos potencial!. Prometedor y muy cerca de convertirse en una realidad, pero potencial al fin y al cabo.
Espero, y deseo de todo corazón que no tarde tanto esa realidad como para hacernos pasar por un infierno durante un tiempo, un espacio temporal que nos haga flaquear de nuestra convicción en «nuestra empresa». Hay que fastidiarse. Como pueden decir una cosa tan distinta, tan opuesta, el lado técnico y el lado fundamental. ¡Pero así es y aquí estamos!.
………………………………………………………………………………………….
…………………………………………………………………………………………….
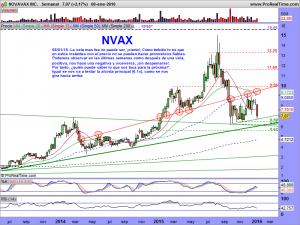
ACTUALIZACIÓN GRÁFICOS 15 DE ENERO DE 2016.
……………………………………………………………………………………………..
Tiene bemoles el asunto de esta semana, pero a la vez era algo que se veía venir; Les comentaba arriba que sus gráficos daban miedo y a fe que al menos un susto importante nos han metido.
Ahora bien, cuando pasan estas cosas, tienen un porqué, siempre es así. Es mas, cuando pasan estas cosas, acabo dándome cuenta de que me falta alguna raya importante que encontrar, una que no vi, o caso de haberla visto, quizá descarté por parecerme demasiado bestia, pero que a la postre, fue tenida en cuenta por los grandes tiburones. La encontré muy rápido, ¡la principal!, la de largo plazo, así como otras «mas secundarias», de medio plazo. La primera había pensado no pintarla hasta final de mes, pues hay que alejarse hasta esa temporalidad para entender su existencia. Pero se la dejaré, así como las otras.
Miren que sencilla, que fácil y que lógica es, vean como cumple con todos los parámetros exigibles en un buen análisis técnico. Es la resultante de unir «3 máximos mensuales», como mandan los cánones. Los máximos históricos de octubre de 2001, los máximos de enero de 2014 y los máximos de octubre del mismo año. ¡et voilà!. La trazamos y encontramos una tendencial bajista, no superada a precio de cierre mensual (ya que hablamos y dibujamos en esa temporalidad), que habría sido superada en diciembre de 2014 y a la cual (¡atención a este detalle!), habría efectuado un perfecto aunque brutal «trowback» con esos 4.98 dólares que dejó como mínimos el pasado jueves, día de autos, día de dolores, sustos y sobresaltos.
De las otras ya les hablé en su momento.
Así que se lo dejo para su estudio y para que comprueben como cuando juegan a algo, por «burro que sea el juego, o lo parezca», buscando, buscando, casi siempre tiene una explicación, una razón de ser.
………………………………………………………………………………………….
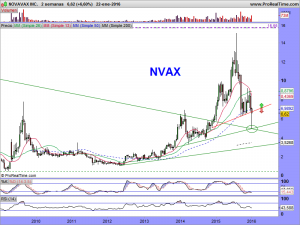
ACTUALIZACIÓN GRÁFICOS 23 ENERO 2016.
…………………………………………………………………………………………..
El pasado miércoles ya les dejé mi opinión con respecto al comportamiento de los mercados, tanto en el cuerpo de la entrada o post de GRÁFICOS (Act.20/01), como en sus comentarios, a la par que ayer también lo incluí en los comentarios de esta misma entrada, por tanto, el tiempo dirá si estoy en lo cierto o no.
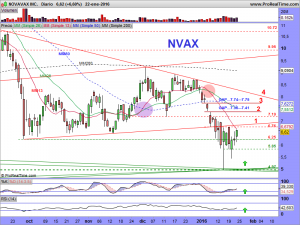
Mientras tanto, les dejo los gráficos de la cotización en diferentes temporalidades; Presten atención a las velas en periodo «Bi-semanal» en especial. Las semanales tampoco son nada baladís, con esas largas sombras por debajo, que nos hablan de intentos sucesivos e insistentes de los osos, por seguir dando una continuidad bajista, y su fracaso, espero que definitivo. El mensual aún debería de maquillarse un poco y el diario, creo que está claro en el mismo lo que tiene que hacer.
¡Ah! y piensen que de confirmarse el escenario que manejo, y perdón por la reiteración, tal cual ha sido la corrección, será la vuelta o escalada; Por tanto, ¡volatilidad!¡volatilidad!¡volatilidad!. Tal como hemos visto entre máximos y mínimos de estas últimas dos semanas un diferencial del 45%, en las siguientes dos o incluso en una, podemos ver eso mismo e incluso mas.
Ese 45% nos pondría muy arriba, pero que muy arriba. Pero bueno, de no ser así, ¡¡llegará!!.
……………………………………………………………………..
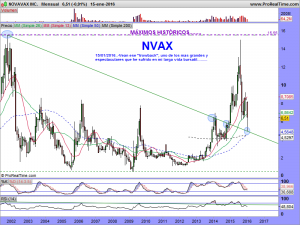
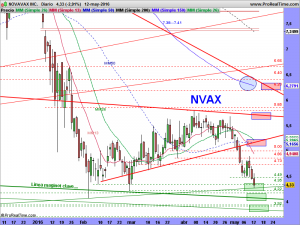
ACTUALIZACIÓN 12 DE MAYO DE 2016.
……………………………………………………………………………………..
Bueno esto se ha deteriorado mucho mucho, y ahora lo que tenemos es esto otro, veremos la evolución y no perdamos la esperanza, por mucho que el aspecto sea feo feo feo………aún quedan defensas.
…………………………………………………………………………………………………
….y por tanto, una vez ajustada la tendencial alcista en el gráfico mensual, quedaría así en el semanal, ¡NO ESTARÍA PERDIDA LA LUZ VERDE DEL SEMÁFORO!…………aún quedaría esperanza.
……………………………………………………………………………………………….
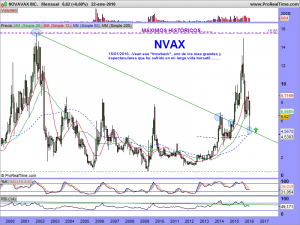
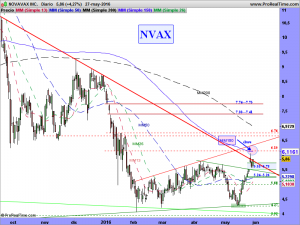
ACTUALIZACIÓN 28 DE MAYO DE 2016.
……………………………………………………………………………………………….
Les iba a largar un mitín de lo que hacen época, pero en el fondo casi que repetía ampliado lo que les escribí en tres comentarios, los pasados días 11, 12 y 13 del presente y esperanzador mes de mayo.
COMENTARIO NÚMERO UNO:
Enviado el 11/05/2016 a las 13:19 | En respuesta a superfungi.
NVAX…Parte 2ª, ¿cuando vender?; Aquí cada uno es dueño y señor de la tecla y del dedo, otra cosa es ser consecuente con lo que se dice, piensa y escribe. En mi caso no lo fui, me pasé meses diciendo y escribiendo que a 15 me prejubilaba y cuando llegó el momento, ¡no lo hice!, espero no tener que arrepentirme el resto de mi vida por no haber sido consecuente, por pensar que se iba a 20, por escuchar músicas parecidas a las que tuvo que escuchar Ulises, por codicioso, ¡por tonto!.
Ahora lo veo de la siguiente manera: Creo en base a lo que va a ir viniendo y si todo acompaña en la misma dirección, que deberíamos ver la cotización cerca de los 7 dólares (se que es mucho) para final de junio, incluso puede que antes. Durante julio y agosto, tener un “calentón” progresivo y constante que la lleve entre los 10/12 dólares, y cuando suelten la news, ver un fortísimo “shortsqueeze” con un pico que ronde los 20 dólares/cromo. ¿Porqué no?. Si el desarrollo fuera así en cuanto a tiempos, yo intentaría vender el 100% de la posición durante el impacto del evento.
Luego, como es lógico, la cotización incluso podría ir a cerrar el hueco dejado y volver a esos 10/12, ….o no, simplemente se podría conformar con testar la parte alta del gap y probar su fuerza, que podría estar sobre los 14/15$. En un punto u otro “re-compraría”, no mas de un 50% de mi anterior posición. El resto a la buchaca. Para proceder igual, repetir jugada, con el anuncio del partner.
Ese es mi pensamiento, espero que no mi cuento de la lechera. Si no sale, ¡no problem!, bueno, ¡si problem!, pero me retiraría de este mundo del bolsín con toda seguridad, con el rabo entre las piernas.
¡Chispum!.
¡¡SIN RIESGO, NO HAY GLORIA!!……………NI FRACASO!! ….solo seguiríamos en la mas absoluta normalidad de vida (ojo!, no tiene porque ser malo), pero a mi, ¡¡ME VA LA MARCHA!!.
…..y miren ustedes que lo paso mal, pero mal, mal…. 
COMENTARIO NÚMERO DOS:
Enviado el 12/05/2016 a las 16:45 | En respuesta a superfungi.
NVAX….Bueno es igual, lo diré: Hay velas que no suelen fallar, ni para lo bueno ni para lo malo, y dos de ellas son: Para lo malo EL HOMBRE COLGADO, para lo bueno EL MARTILLO INVERTIDO.
Ambas funcionan por lo mismo que les expliqué antes, o como escribía posteriormente Framus, “el AUTO-CUMPLIMIENTO”; Transmiten al mercado una señal muy potente cada una en un sentido y mas importante cuanto mas larga sea la temporalidad. A mi en semanal, me encanta.
Ahora echen un ojo al gráfico semanal de NVAX y observen lo que se va dibujando y como puede quedar el asunto mañana…..¡ala, ya está!.
Sería muy importante que lo terminara haciendo, ¡¡MUY IMPORTANTE!!……y no le den publicidad en lo posible, para que no nos lo chafen……jejejeje
TOMEN NOTA!!!.
COMENTARIO NÚMERO TRES.
Enviado el 13/05/2016 a las 23:31 | En respuesta a Pedrol.
NVAX…bueno, a escondidas les anticipo “MARTILLACO INVERTIDO” en semanal, me da que se invierte la tendencia…¡¡TOMEN NOTA!!….y no tengo ordenador, ando con el móvil….pero, MARTILLACO INVERTIDO!!. 
….ahora a confirmar bonito!!!
….y una buena manera sería abrir el lunes por encima de los 4.52 aunque después haga mínimos mas bajos, pero luego nos iríamos hacia arriba…..bueno primer martillo invertido después de 9 meses de tendencia bajista, ¡no está mal!, porque el de la semana del 26 de octubre, para mi no lo es, no reune requisitos técnicos. Creo que si confirma la próxima semana, ¡volvemos!.
Cuando escribí el primero, estaba la cotización a un +60% de esos 7 dólares de los que hablaba para finales de junio, hoy 17 días después, estamos a un 20%, la cosa va cambiando, ¿verdad?.
El martillo invertido en semanal lo anunció con claridad, y ya se que muchos de ustedes siguen pensando que el AT no sirve para nada, pero es lo que hay. No voy a insistir mas en que no falla el chart, si no el chartista. ¡Allá cada cual con lo que cree!.
Ahora, una vez que el tenemos al precio de vuelta, con dos soldados verdes en semanal (+18.82% y +11.83%) que preludian un tercero que de andar por esos porcentajes, imaginen donde nos podría llevar, tenemos a punto de caramelo la news del «constipado», como yo la llamo, a continuación, puede que novedades BARDA, para casi sin respiro, el anuncio de resultados de la esperada FASE III de lo que ustedes saben, y seguro que a continuación un mas que probable comunicado de quien es el PARTNER y lo que pone sobre la mesa en forma de maná, para terminar y comenzar el año, con grandes señales de humo sobre OPAS y cosas de esas, lo rotulado arriba, …..»APASIONANTE 2016″.
¡Ah!, y por último, les dejo los gráficos para aquellos que crean algo en el AT; El resto pueden pasar de ellos, incluido el último de un indicador personal, que parece predecir tan mal, las entradas y salidas, el momento de comprar y vender en el precio. Otra cosa, como siempre, es el caso que le ha hecho un servidor para su desgracia, pero esa es otra historia.
………………………………………………………………………………………….
……………………………………………………………………………………………………………..
ACTUALIZACIÓN GRÁFICA 2 DE JULIO DE 2016
……………………………………………………………………………………………………….
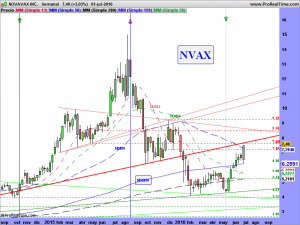
Bien amigos, les dejo los gráficos en semanal y diario; El resto se lo dejé escrito los días 11, 12 y 13 del pasado mes de mayo, cuando caían chuzos de punta (lo pueden repasar un poquito mas arriba). Ahora estando en los 7.5$, parece mas fácil decir que veremos los 9, 10, 11, etc., entonces no lo era tanto, ¿verdad?. Incluso alguno de ustedes que ahora lo ve fantástico, escribía que veía imposible lo que les escribía, pero el tiempo hace los deberes.
……………………………………………………………………………………………………
ARTÍCULOS RELACIONADOS:







nvax-..sobre el tema cortos, es intrigante la estrategia que llevan a cabo por las siguientes reflexiones que me hago, si ellos controlan mas del 90 % de las acciones, no creo que por ese 6% en nuestras manos les importe que quien tenga la paciencia de aguantar se pueda beneficiar de ello, diferente seria un 40%/60% o viceversa. A nivel pequeño inversor yo si tuviera miles de acciones de Santander de muchos años y no confiara en la empresa para el futuro por alguna razón las venderia, pero ,…. si detectara que el mercado en general o el sector bancario en particular tuviera tendencia bajista evidente sin duda me podría corto en CFD’s SAN , pero no venderia mis acciones . Por lo tanto, pienso que sin duda confían plenamente y tienen conocimiento del éxito de nvax y del potencial futuro, lo único que no acierto a comprender ese afán de total control cuando son ellos quienes los dueños de nvax, ya se que hemos comentado en otras ocasiones que esa estrategia les hace ganar mas dinero, pero no a todos los institucionales sino a algunos de ellos con la permisividad o el consentimiento de los otros que esperan ansiosos el trozo de tarta que les corresponde y nosotros no les importamos un pimiento. Bueno, los sueños dan para mucho y la cabeza no para, debe ser la ansiedad de que sea agosto / septiembre… : Buen fin de semana a todos..
NVAX
Tranquilos, hoy tengo que vender unas cuantas acciones para hacer frente a diversos gastos, así que a partir del lunes esto se dispara. La ley de la bola de cristal china es infalible…
Súper, que el remiendo sea de su agrado. Vaya contando…
Nvax
Como me gusta su indicador…no nos deje sin el please. Espero que todo bien con la herida de la cirugía
Nvax
Venga que la semana que viene nos tienen q soltar algo ya…..esos 2 meses…tic tac tic tac…….
Nvax.-
Parece que no somos la excepción de los cortos. En el articulo que subo, a A.F. le preguntan por qué cree que hay tantos cortos en Sarepta (SRPT) también tiene bastantes institucionales, sobre el 63% y con un 40%de las acciones en posiciones cortas.
http://www.thestreet.com/story/13531459/1/biotech-stock-mailbag-sarepta-therapeutics-big-event-is-coming.html
Nvax.-
El innombrable menciona la forma que tiene de proceder ante dicha situación y es la de preguntar a sus «conocidos» inversionistas el por qué o la causa de adoptar esa posición, o sea va a la raíz del asunto, pero fijaros la contestación; en este caso de SRPT no le dan un motivo concreto «científico», lo dejan únicamente en el riesgo, en la volatilidad.
NVAX. Volumen, seca. Así a donde la quieran llevar que fácil es. Día de opciones y tal y tal …
NVAX
He picado 1’2k para jugar un poco con ellas… Si bajan pues ahí se quedan con las demás.
NVAX…..Bueno, pues qué les cuento a ustedes?, ¡ya me dirán!, viendo como está esto, poca cosa, salvo que no se si se habrán enterado de que aún no tenemos gobierno……….¡ah!, y que ya no pito en un scaner, ¡ya no tengo grapas!
¡Jo que aburrimiento!
NVAX…….y mientras el EUR/USD….
…………………………………………………………………………………………
NVAX…..y en dos horas no hemos llegado al millón de cromos intercambiados, igual nos la cierran a 5.52 para seguir con el «cachondeo» de otra semana mas en positivo, aunque sea céntimo a céntimo….
Nvax
1200 cromos más para la buchaca (22200 cromos a 7,057$)
NVAX. Ja ja Super, ya puedes subir a un avion sin que te pite el arco de seguridad
Yo he pescado de nuevo en 5,47. Frente al aburrimiento … EL METE-SACA
NVAX…..poco juego da el mete saca ahora mismo
NVAX. Oye, a 500 pavos 2-3 veces por semana uno puede vivir, eh?
NVAX….Eso si, y no mal precisamente
NVAX…pues en diario, por primera vez desde el 12 de febrero, da venta…………
NVAX. Si hoy toca los 5,57 sera el 3er metesaca. Lo veo complicadillo, la verdad. Pero.no hay prisa.
NVAX…..Pues ala, ala, ¡suerte!…..tiene mas pinta de que vamos a ver los 5.2x (quizás no hoy), que de otra cosa…………pero aquí hay tanta mangancia…….
NVAX. shhhh no me estreses el metesaca diciendo cosas tan feas, hombre
Lqmt.-
Toni, esto no se mueve. Estamos ya cerca de un mes en el mismo sitio y no se desencadena la tormenta.
¿Cómo lo ves tirará para arriba pronto?
Si te das cuenta más o menos se ha quedado al precio medio de los tres bloque que el chino tiene que comprar.
Saludos.
NVAX
A mi se me escapó el metesaca… fijé salida en 5’51, los tocó pero no se me ejecutó mi orden. La idea es ir sacando para algún caldo que últimamente me estoy aficionando (demasiado diría yo).
Buen fin de semana a todos.
NVAX. Señores, aqui os dejo lectura de fin de semana. Para que os empapéis bien.
NOVAVAX – NEEDHAM HEATHCARE CONFERENCE – TRANSCRIPCION
Abril 2016 –
CONFERENCE CALL PARTICIPANTS
Stan Erck
Scott Pettit
PRESENTATION
Unidentified Participant
Okay. Good morning everybody and welcome to the 15th annual Needham Healthcare Conference. Very happy to have presenting for us at this
time Novavax and represent ting for the Company is their President and CEO, Stan Erck.
Stan Erck
All right. Thank you and good morning, everybody. Welcome to the Novavax presentation. I will spend the next couple of minutes introducing the Company and the opportunity and I will turn it over to Greg Glenn to is our President of Novavax R&D and head of all of the technical and clinical development for the Company and he’ll give you the meat of the presentation which is the clinical status of our programs.
We have — as you all probably know we are a vaccine company. All of our products are based off a single platform of developing nano particle-based vaccines which can be used across a broad range of pathogens. We have now late stage products. As you’ll hear we’ve entered two Phase III clinical trials. We’ve over the years developed great partners for both the relationship with BARDA, who has funded the development of our platform for influenza. Their primary interest is for pandemic influenza and ours is to develop a seasonal influenza vaccine based upon the nano particle technology and with the Bill and Melinda Gates foundation to recently joined us in funding a program for maternal immunization which Greg will tell you about we are developing products for large markets and plan on taking our first product into the market on our own. So the pipeline as you’ll see from the slide is robust. We have last year in 2015 we unblinded five clinical trials in the time frame for roughly June through September.
All of those trials gave us data that had a smooth the products forward through late stage clinical trials. Two of them ended with end of Phase II meetings with the FDA which is the meeting that you have in advance of a Phase III initiation and both of those meetings were successful. In November we started two Phase III clinical trials. In the fourth quarter of last year I think that’s possible — it’s unprecedented in biotech history for a company with its first two products to go into Phase III clinical trials at the same time period. The first trial was in older adults where we vaccinated 11,850 people over a five week period in November and early December and then we began our first trials in pregnant women in December in the US and have followed that up by developing a global program and vaccinating pregnant women in South Africa.
We have a pediatric program in RSV which represents a third of the three RSV products. Influenza trials in both the Quadra valent seasonal vaccine and in pandemic influenza. And then new opportunities — our platform allows us to address emerging viruses such as Ebola, a seven and nine and the pandemic and others very quickly. And the last program that you see on this slide is our combination respiratory vaccine where we combine both the flu vaccine and the RSV vaccine both of which are seasonal diseases overlapping each other. Flu and RSV season in the Northern Hemisphere occurs in roughly December through April and atypical time to get vaccinated is in the fall in advance of the flu season. So our goal is to have one vaccine ultimately which addresses both RSV and influenza.
So our platform is a new paradigm. We have — I’ll let Greg explained this further but we have a technology that allows us to make antigens uniquely that expose surface areas that stimulate very robust immune responses to pathogens that aren’t stimulated similarly by other traditional vaccines.
The Company strategy has been and continues to focus on large market opportunities. Our goal is to have the first RSV vaccine. This is a disease area that companies in the vaccine world have focused on for as long as 50 or 60 years. We made a breakthrough for five years ago in a Phase I trial and we’ve been following that up in Phase II and now in Phase III. So it’s a competitive fields that we’ve left ahead of by at least a couple of years and we have developed the first vaccine to show efficacy in any population for the RSV market.
We will develop the RSV vaccine first in the elderly and bring it to market in the US and plan to partner it outside of the US with global vaccine companies. So it’s a large market. The RSV market is a large market. We think it’s the biggest unmet need for a vaccine that exists right now. It carries a huge disease burden approaching $100 billion in the large developed countries but it’s a global problem as well. And we are developing the product particularly for pediatric — to protect newborns by vaccinating pregnant women globally. So what we’ll talked about is the three target markets. In older adults there are over 2.5 million annual infections in the US. Maternal immunizations — 1.4 million infants contract RSV and as I mentioned before very large market her disease burden. And we’ll develop both these vaccines in Phase III — so over the next year or two. And with that let me introduce Greg Glenn who will talk about introducing the technology and the state of the clinical trials. And I will also entertain you with a video which shows our technology in a cartoon fashion. (video playing)
Scott Pettit
Okay. Well thank you very much for coming this morning and your interest in Novavax and RSV. As a grizzled vaccineologist I can tell you it’s a very exciting time in my field in particular with RSV driving a lot of that excitement. If you were trying to change global public health you would invest in clean water for the world and vaccines. So these are technologies that are going to have a major impact based on the disease burden and the effectiveness of the vaccine.
So to that point you can see a US flag in the corner there. This is a comparison of the disease burden from two license vaccines in the same space and you can see the larger circle represents the number of infections and as you can imagine sort of the peer amid of severity of disease represented here by circles where you see hospitalizations and deaths. And the point of this is to illustrate the burden of RSV disease as we understand today in comparison with some vaccines that are licensed in terms of hospitalization and deaths RSV compares quite well with both influenza and pneumococcus where there are licensed vaccines. And particularly pneumococcus is of interest because the market size for the pneumococcal vaccine — the new vaccine called Prevnar is very large and I think quite comparable in terms of its market.
This is — now a relevant study for us as we are in a Phase III trial — as Dan mentioned we just started this in November of this year and have just moved through an RSV season. Our trial single-season RSV trial where we immunized adults 60 and older and then they are doing active and passive surveillance through the season.
What this slide illustrates is the relative predictability of RSV disease. This is a 14 year study looking at the burden of disease. RSV in the UK and in primary care setting the upper graph and then with hospitalization and death below. And you can see in red RSV and in blue, flu. So a couple of points — the attributable disease burden RSV is quite high and very comparable to seasonal flu in the study and then the consistency of which you see RSV attack rate which is really critical for trial conduct is illustrated as well. So RSV is what I would say is a predictable annual epidemic. So when you do your trial conduct in your operations that’s extremely important. There is a well circumscribed season and a consistent attack rate for RSV and that’s been the case this year for us during this really critical time of our Phase III trial.
So Stan mentioned that we’ve made in RSV-F protein. This is the fusion protein that acts like a syringe to inject the genetic material of the virus in the host cell and its structure and function is important. It actually has sites that are what we call highly conserved — so RSV has been around a long time. It undergoes changes, like flu. So as a vaccine maker targeting the parts of the protein that are conserved and do not change from year to year it’s really a big breakthrough so we can make one vaccine and use it again and again — unlike flu, which requires chasing these strains that evolved over time. So site one, site for, and site to our sites that we will call conserved and they elicit what we call broadly neutralizing antibodies.
So you have immunity to those sites — the strain changes are then not going to decrease the vaccine. What’s been so particularly compelling for us going into a field where there has been 60 years of attempts to make an RSV vaccine is site two was defined by meta-meme in the past — they made a monoclonal antibody to the site, called palivizumab. That monoclonal antibody binding to that site has been shown to be effective in preventing RSV in five randomized clinical trials. So the biology of this F protein-based approach has been proven — well it’s proven in our view. And we presumed that if we made a vaccine that could elicit this type of immunity then the vaccine should be protected. And I think we stand here today with now evidence that that hypothesis and paradigm is actually true and we’ve had Phase II data showing it’s in fact protected.
So we can measure antibodies at site two. They are called palivizumab competing antibodies and I’ll show you some data on that in just a second. So last year we did a fairly large Phase II trial in vaccines. You can often test the efficacy of the vaccine before you go to pivotal trial. And this trial was designed to describe the epidemiology of RSV in the context of the sort of trial we are doing in Phase III. So to describe the incidence or the attack rate of RSV and look at the immune responses and then to look at the vaccine effects in terms of estimating the efficacy. So we did that – it was a very I think instructive trial for us in Phase II and that allowed us to define the endpoints for the Phase III trial we are currently undergoing.
Here you see the immune response to the vaccine over time. This is a single dose given as an injection — typically like the flu it would be an annual seasonal vaccine in our view. And you can see the blue line represents the anti-F IDG responses from (inaudible) from subjects who were not given the vaccine. And actually what you can see there is there is a fair amount of anti-F immunity amongst the general population and that’s a result of the annual or semiannual — sorry every other year infection that most adults have. So you all get RSV infections on a frequent basis. You develop very robust immunity but the enigma here has been that the community is not protected and but you can see here based on placebo that it’s common to have quite robust anti-F immunity amongst the population. When we vaccinate you can see we have about a fivefold rise. These are again older adults — so they are over 60 so they have relative immune senescence and yet our vaccine is giving quite a robust anti-F IDG response.
When you look at the palivizumab at site two that reflects the kind of immunity that was seen with the monoclonal antibody. Again, you can see quite robust responses and these would be at levels that we consider should be in the protected range if it mirrors these sort of efficacy seen with palivizumab. Again very robust responses. And what’s interesting here is despite the fact people have had recurrent infections, the blue line actually is drawn
at the limit of protection which means that amongst the general population there’s almost no antibody to this conserved site and we think that that’s been an important explanation for the reasons that people have recurrent infections from year to year — because they don’t have this type of activity which we think is a critical feature needed for protection. So our vaccine displays the site induces immunity to it and in contrast to natural infection it should be therefore protected. And this is what we saw. This is a Kaplan-Meier curve. You can see time is on the X axis and the percent of subjects that did not have RSV over time developed — first of all what we determined here which is consistent with what we saw in the literature is we had relatively — we had a 5% overall rate of RSV infection which in the context the vaccine is a very high attack rate. And you can see the divergence of the vaccine population over time really persisting throughout the season. This is a highly significant effect of the vaccine – so decreasing the rate of RSV infections.
Now when you look at this in terms of what we might take into our endpoints you can see here now that we had a 40% reduction in RSV infection of any kind, which I think is a very high bar for vaccine. And then we looked at clusters of lower respiratory tract symptoms we saw that the vaccine of efficacy was around 64% and the more we clustered this in terms of lower respiratory tract infections the greater the vaccine effect. So how does this compare to the licensed vaccine Prevnar which has been commercially very successful from a public health standpoint – very successful vaccine. And you can see here in their Phase III trial they saw sort of the middle bar there is what their primary endpoint was to reduce vaccine strain related confirmed community acquired pneumonia. And they saw vaccine efficacy around 46%. So that’s what their label claim states — prevention of vaccine strain confirmed community acquired pneumonia and that efficacy is having a large impact on the public health of pneumococcus.
If you look at a more severe outcome which is the secondary endpoint of the trial — invasive pneumococcal — you can again see the vaccine efficacy increases as you go up in the severity of the disease. So very much reflecting our experience from any RSV to more severe signs and symptoms as you see vaccine efficacy declines. Now if you look again at the upper table these two findings now are what we have taken into our Phase III trials or endpoints. In this we made our primary endpoint reflecting this sort of outcomes you see here and in this we’ve made our secondary endpoint. So what are we doing? I know as a mentioned in November we enrolled 12,000 subjects. These are people that are over 60. They have — they are fundamentally healthy. They have cardiopulmonary disease but they are not in the hospital. And our goal here — our primary endpoint is to prevent moderate to severe RSV associated lower respiratory tract infections as defined by these multiple lower respiratory tract systems. The FDA did us a great favor by giving the moniker a moderate to severe RSV infection. So we are looking to prevent moderate to severe RSV infection. It’s all been — they were immunized in the November/December time frame. We are going through a single season. This is 16 sites across the US.
So what does that leave us? We are about done. Surveillance will end in May. We expect to announce the data in the quarter three time frame. That will allow us to then file a BLA and you can see the March to buy structure through FDA approval and then launch. So we are going to also turned quickly to the incense. So here we are trying to protect infants through immunizing from other. This is a natural mechanism by which infants — when they are born they have acquired the complete repertoire of immune responses — antibody responses that the mother has acquired through life; so they are protected for the first few months of life. The enigma here again as a mentioned even though they do have a very high level of RSV antibodies these are not highly effective in protecting infants so the peak disease in infants is in the first few months of life when they are in fact armed with the antibodies from the mother.
So what we are doing is immunizing from others. They have 100% of the mothers antibodies. This is a mechanism where the antibodies are transferred actually from the mother to the infants so it’s a very elegant mechanism used by licensed vaccine for flu and pertussis to prevent those diseases in the infants themselves. We of course are looking to see the transfer of these palivizumab like antibodies in others that are broadly neutralizing. So we did a Phase II trial. We reported results last fall. Really it was very much about safety in infants and mothers. And in looking at the immune responses in the infants and mothers and looking for antibody transfer to the infants as they are our primary target what you can see here is the placental antibody transfer we have a number of immune measures including the response to the vaccine and the F protein. The palivizumab like antibodies — and these are called neutralizing antibodies. What we found here is that you can see quite robust transfer. In fact there’s relative concentration of antibody from the infant to the mother — or sorry, from the mother to the infants and so they end up with roughly 20% more antibodies. This just is a somewhat complicated slide in that we found which is consistent with the literature that if there is enough time for the antibodies to (inaudible) — those immunized mothers who delivered 30 days after immunization had more robust antibody transfer than those who were essentially immunized and delivered within a few weeks of the immunization.
These are robust responses. They should be protected and we are quite optimistic that that will be the case in infants. There is one other feature here that we have on our website that is kind of complicated, but these are these broadly neutralizing antibody sites. This is a palivizumab site. There are others that were defined long ago. Met immune simply selected one to commercialize. These others are expected to have the same activity. And it’s the same story if you look in the general population — these are the main mean titers. They really float around the limit of quantitation — that is they are very very low. They seem to be hidden. Our vaccine is soliciting very robust antibody responses and those are being transferred to the infant. So we have many reasons to expect the vaccine should be efficacious based on the science and the historical experience with these antibodies. So the Phase II trial we had very well tolerated vaccine. It’s highly purified — you expect that. We had robust antibody transferred to the infants with around 120% antibody levels showing up in the infants. And we expect that to have a half-life of around 41 days and we expect to have very robust protection for at least a minimum of 90 days which is reflected in our endpoints. So here we started a Phase III trial. It’s a global trial so RSV is a global disease — it’s predictable epidemic in infants and seniors and we’ve gone -we’ve taken advantage of factors in northern and southern hemisphere that’s very well-defined. And here we are looking to prevent lower-respiratory tract infection as measured by hypoxemia which is a pulse oximeter measure of the infant. So when they have disease they stop oxygenating well and we’ll look for that for the first 90 days.
This is PC are positive so this is active and passive surveillance is going on. We’ll do a secondary endpoint which is a more severe hypoxia and also looking for the vaccine effect out to six months. This is a large trial — global trial. It’s done in a group sequential manner which allows us to adjust the trial size base on the vaccine effect that will be evaluated in a positive fashion by independent DSMB. And we mentioned earlier this is a major priority at the foundation. They’ve thrown in $90 million to support this Phase III trial. This is really historic. We have a lot of excitement in our world — our little vaccine world based on this trial. So these are reasons that we’ve had a lot of confidence moving forward. First of all, we did a lot of work at a preclinical model which was predictive for palivizumab efficacy in the field so we had many things to look at especially the antibody levels and their qualitative effect. So we do pretty early on that are vaccine should be protective. We then saw as we look at our different dosing regimens and in vaccines you have to in the Phase I and Phase II setting you determine your dose and your dose schedule and we — as a secondary we also look for — these people went through an RSV season. We saw repeatedly that we were reducing infection in healthy women of childbearing age.
Again I would say a very high bar for vaccine biology — biologic effect. So that gave us confidence. I just reviewed for you that we were able to show in a prespecified manner that we could prevent symptomatic RSV infection in older adults and this efficacy was greater against more severe endpoints. Again very consistent with the general findings from the field of vaccineologist. And then we think we are in very good shape with transferring those antibodies to infants in the maternal immunization setting. There has been — this is not new. There’s been a tremendous amount of activity because the disease burden and the market size is so great over many years. There’s been very few trials that advance out of Phase I. This a lot of activity in Phase I still. We have — you can see we are in Phase III and I think we are several years ahead of the competition. GSK has a maternal immunization program and met immune has an older adult vaccine program that are again in Phase II.
This just very briefly — is influenza. We have shown nice data in the Phase II setting under our contract with BARDA to make both a quarter Valent seasonal vaccine and a pandemic vaccine which is what BARDA is primarily interested in being able to respond to a new novel strain of flu that might come through. We believe there is great commercial opportunity for combining the RSV and flu vaccines on our lifecycle management. We are expecting to get into a trial to show this. I think it would be very instructive even though it would be a potential Phase I trial. As we’ve learned so much about RSV in our Phase I trial we expect to do the same with our combination respiratory vaccine.
So here’s our calendar — Phase III pivotal trial. It’s a big year for us. This will be a historic result in older adults. That data will be in the third quarter. We’ve also done a booster trial because this is an annual seasonal vaccine, so it’s important to show its face and it has an immune response that’s built so over one year of the immune response to our vaccine should be expected to wane. This is actually a very important trial and then we expect to initiate the trial in this combination respiratory vaccine. In summary we are the only RSV vaccine to demonstrate protection. We have two Phase III candidates. We have a first in market commercialization advantage global rights and this is a very good technology that has applications to many diseases. I think with that we will take questions. Thank you very much.
QUESTIONS AND ANSWERS
Unidentified Caller
(microphone inaccessible)
Stan Erck
We built then a lot of wiggle room. So this has been what I would say is a normal RSV season. What may help us is it has not been a normal flu season so if you look at the CDC website you can track what happened with influenza like illness during the first two months of our surveillance period there was almost no flu in the US. So I think that will help us. Just enriches the PC are positive rates. But otherwise it looks like a very what I would say normal RSV season. Again, you can track that at the CDC so that’s a very important point. We’ve been as I mentioned at the beginning — I think we’ve known this from history that RSV attack rates are extremely predictable and that it’s critical for conduct in the trial. So we are able to I think justified taking this in a single-season US trial based on that history.
We built then — we powered our trial for our primary endpoint over 90% so very robust power so that allows us to have wiggle room both in the estimate of vaccine efficacy and attack rate.
NVAX…..TRADUCCIÓN BY GOOGLE TRASLATOR
Participantes de la conferencia
Stan Erck
scott Pettit
PRESENTACIÓN
Participante no identificado
Bueno. Buenos días a todos y bienvenidos a la 15ª Conferencia Anual de Salud Needham. Muy contentos de haber presentando para nosotros en este
Novavax tiempo y representan ting para la compañía es su presidente y CEO, Stan Erck.
Stan Erck
Todo bien. Gracias y buenos días a todos. Bienvenido a la presentación de Novavax. Voy a pasar el próximo par de minutos la introducción de la Sociedad y de la oportunidad y voy a darle la vuelta a Greg Glenn es nuestro Presidente de Novavax I + D y la cabeza de todo el desarrollo técnico y clínico para la sociedad y el te dará la carne de la presentación, que es el estado clínico de nuestros programas.
Tenemos – como todos ustedes probablemente saben que somos una compañía de vacunas. Todos nuestros productos están basados en una única plataforma de desarrollo de vacunas basadas en nano partículas que pueden ser utilizados en una amplia gama de patógenos. Ahora tenemos productos en fase tardía. Como se escucha hemos entrado en dos ensayos clínicos de fase III. Hemos desarrollado en los últimos años grandes socios, tanto para la relación con Barda, que ha financiado el desarrollo de nuestra plataforma para la influenza. Su interés principal es para la influenza pandémica y la nuestra es desarrollar una vacuna contra la gripe estacional en base a la tecnología de nano partículas y con la fundación Bill y Melinda Gates para nosotros incorporado recientemente en la financiación de un programa de inmunización materna la que Greg le dirá sobre el que estamos desarrollando productos para grandes mercados y el plan de tomar nuestro primer producto en el mercado por nuestra cuenta. Por lo tanto la tubería como se verá a partir de la diapositiva es robusto. Tenemos el año pasado en 2015 que no cegada cinco ensayos clínicos en el marco de tiempo de aproximadamente de junio a septiembre.
Todas estas pruebas nos dio datos que tenía un suave los productos hacia adelante a través de ensayos clínicos en fase tardía. Dos de ellos terminaron con el final de la fase II reuniones con la FDA, que es la reunión que tiene antes de un inicio de fase III y dos de esas reuniones tuvieron éxito. En noviembre, hemos iniciado dos ensayos clínicos fase III. En el cuarto trimestre del año pasado creo que eso es posible – es sin precedentes en la historia de la biotecnología para una empresa con sus dos primeros productos para entrar en ensayos clínicos de fase III en el mismo período de tiempo. La primera prueba fue en los adultos mayores, donde vacunamos a 11.850 personas durante un período de cinco semanas en noviembre y principios de diciembre y luego comenzamos nuestros primeros ensayos en mujeres embarazadas en diciembre en los EE.UU., y hemos seguido que por el desarrollo de un programa global y la vacunación de embarazadas las mujeres en África del Sur.
Tenemos un programa pediátrico de RSV que representa una tercera parte de los tres productos de RSV. ensayos de la gripe, tanto en la vacuna estacional Quadra valente y en la influenza pandémica. Y a continuación, nuevas oportunidades – nuestra plataforma nos permite abordar nuevos virus como el Ébola, un siete y nueve y la pandemia y otros muy rápidamente. Y el último programa que se ve en esta diapositiva es nuestra vacuna respiratoria combinación en la que combinamos tanto la vacuna contra la gripe y la vacuna contra el VRS ambos de los cuales son enfermedades estacionales se solapan entre sí. La gripe y la estación del VRS en el hemisferio norte se produce en aproximadamente de diciembre a abril y la hora atípica para vacunarse es en el otoño antes de la temporada de gripe. Por eso nuestro objetivo es tener una vacuna en última instancia, que se ocupa tanto de RSV e influenza.
Así que nuestra plataforma es un nuevo paradigma. Tenemos – Voy a dejar Greg explicó más a fondo, pero tenemos una tecnología que nos permite hacer antígenos forma única que exponen a las superficies que estimulan la respuesta inmune muy robustos para los patógenos que no son estimuladas de manera similar por otras vacunas tradicionales.
La estrategia de la empresa ha sido y sigue centrándose en grandes oportunidades de mercado. Nuestro objetivo es tener la primera vacuna contra el VRS. Este es un tipo de enfermedad que las empresas en el mundo de la vacuna se han centrado en el mayor tiempo como 50 o 60 años. Hicimos un gran avance para hace cinco años en un ensayo de fase I y que hemos seguido hasta que en la Fase II y ahora en la Fase III. Así que es un campo competitivas que nos hemos ido por delante de por lo menos un par de años y hemos desarrollado la primera vacuna para mostrar eficacia en cualquier población para el mercado de RSV.
Vamos a desarrollar la vacuna contra el VRS por primera vez en los ancianos y llevarlo al mercado en los EE.UU. y el plan de asociarse fuera de los EE.UU. con las compañías de vacunas globales. Así que es un gran mercado. El mercado RSV es un gran mercado. Creemos que es la mayor necesidad insatisfecha de una vacuna que existe en este momento. Se lleva una enorme carga de morbilidad de los $ 100 mil millones en los grandes países desarrollados, sino que es un problema global. Y estamos desarrollando el producto en particular para pediátrica – para proteger a los recién nacidos mediante la vacunación de mujeres embarazadas en todo el mundo. Así que lo que vamos a hablar es de los tres mercados de destino. En los adultos mayores, hay más de 2,5 millones de infecciones anuales en los EE.UU.. vacunas maternas – 1,4 millones de niños por VRS contrato y como he mencionado antes de mercado muy grande de su carga de enfermedad. Y vamos a desarrollar estas dos vacunas en Fase III – por lo que durante el próximo año o dos. Y con eso voy a presentar Greg Glenn que hablará de la introducción de la tecnología y el estado de los ensayos clínicos. Y yo también te entretener con un video que muestra nuestra tecnología de forma de dibujos animados. (Reproducción de vídeo)
scott Pettit
Bueno. Bien, muchas gracias por venir esta mañana y su interés en Novavax y RSV. Como vaccineologist canoso te puedo decir que es un momento muy emocionante en mi campo, en particular, con el VRS conducir una gran cantidad de ese entusiasmo. Si estaba tratando de cambiar la salud pública mundial que le invertir en agua limpia para el mundo y vacunas. Así que estas son las tecnologías que van a tener un impacto importante sobre la base de la carga de la enfermedad y la eficacia de la vacuna.
Así que para ese momento se puede ver una bandera de Estados Unidos en la esquina allí. Esta es una comparación de la carga de la enfermedad a partir de dos vacunas de licencia en el mismo espacio y se puede ver el círculo grande representa el número de infecciones y como se puede imaginar una especie de pares en medio de la gravedad de la enfermedad representada aquí por los círculos donde se ve hospitalizaciones y muertes. Y el punto de esto es para ilustrar la carga de la enfermedad por VRS tal como la entendemos hoy en día en comparación con algunas vacunas que tienen licencia en términos de hospitalización y muertes por VRS compara bastante bien con la gripe y el neumococo donde existen vacunas autorizadas. Y en particular el neumococo es de interés debido a que el tamaño del mercado para la vacuna neumocócica – la nueva vacuna llamada Prevnar es muy grande y creo que bastante comparables en términos de su mercado.
Esto es – ahora un estudio pertinente para nosotros, ya que estamos en un ensayo de Fase III – Dan mencionó que acaba de comenzar este en noviembre de este año y acaba de mudar a través de una estación del VRS. Nuestro ensayo en una temporada de prueba RSV donde inmunizados adultos mayores de 60 años y después que están haciendo la vigilancia activa y pasiva a través de la temporada.
Lo que esta diapositiva ilustra es la previsibilidad relativa de la enfermedad por VRS. Este es un estudio de 14 año en busca de la carga de la enfermedad. RSV en el Reino Unido y en el establecimiento de la gráfica superior de la atención primaria y luego con la hospitalización y la muerte abajo. Y se puede ver en la RSV rojo y en azul, gripe. Así que un par de puntos – la carga de la enfermedad atribuible RSV es bastante alto y muy similar a la gripe estacional en el estudio y la consistencia de la que se ve la tasa de ataque de RSV que es realmente crítico para la realización del ensayo se ilustra también. Así RSV es lo que yo diría que es una epidemia anual predecible. Así que cuando usted hace su conducta juicio en sus operaciones eso es extremadamente importante. Hay una estación bien circunscrita y una tasa de ataque consistente para el VRS y ese ha sido el caso este año para nosotros durante este tiempo muy crítico de nuestro ensayo de fase III.
Así Stan mencionó que hemos hecho en proteínas RSV-F. Esta es la proteína de fusión que actúa como una jeringa para inyectar el material genético del virus en la célula huésped y su estructura y función es importante. En realidad, tiene sitios que son lo que llamamos altamente conservadas – por lo RSV ha existido desde hace mucho tiempo. Se sufre cambios, como la gripe. Así como un fabricante de vacunas dirigidas las partes de la proteína que se conservan y no cambian de un año a otro es realmente un gran avance por lo que se puede hacer una vacuna y utilizar una y otra vez – a diferencia de la gripe, que obliga a perseguir estas cepas que evolucionaron horas extra. Así sitio de uno, sitio para, y el sitio de nuestros sitios que llamaremos conservada y obtener lo que llamamos anticuerpos ampliamente neutralizantes.
Por lo que tiene inmunidad a esos sitios – los cambios de tensión luego no van a disminuir la vacuna. ¿Cuál ha sido tan particularmente convincente para nosotros entrar en un campo en el que ha habido más de 60 años de intentos de hacer una vacuna contra el VRS es el sitio de dos fue definido por el meta-meme en el pasado – que hicieron un anticuerpo monoclonal para el sitio, denominado palivizumab. Que el anticuerpo monoclonal que se une a ese sitio se ha demostrado ser eficaz en la prevención de RSV en cinco ensayos clínicos aleatorios. Por lo que la biología de este enfoque basado en la proteína F se ha demostrado – así está demostrado en nuestra opinión. Y que presume que si realizamos una vacuna que podría provocar este tipo de inmunidad a continuación, la vacuna debe ser protegida. Y creo que estar aquí hoy con ahora pruebas de que esa hipótesis y paradigma es realmente cierto y hemos tenido datos de fase II que muestra que está de hecho protegida.
Por lo que podemos medir los anticuerpos en el lugar de dos. Se les llama palivizumab anticuerpos que compiten y yo voy a mostrar algunos datos de que en tan sólo un segundo. Así que el año pasado hicimos un bastante grande ensayo de Fase II en las vacunas. A menudo se puede probar la eficacia de la vacuna antes de ir al ensayo pivotal. Y este ensayo se diseñó para describir la epidemiología del VRS en el contexto de la clase de juicio que estamos haciendo en la Fase III. Así que para describir la incidencia o la tasa de ataque de RSV y mirar las respuestas inmunes y luego mirar a los efectos de la vacuna en cuanto a la estimación de la eficacia. Así lo hicimos – fue una muy pienso juicio instructivo para nosotros en la Fase II y que nos permitió definir los puntos finales para el ensayo de Fase III que estamos viviendo actualmente.
Aquí se ve la respuesta inmune a la vacuna con el tiempo. Esta es una dosis única en inyección – por lo general como la gripe sería una vacuna estacional anual en nuestra opinión. Y se puede ver la línea azul representa las respuestas anti-F IDG de (inaudible) de los sujetos que no recibieron la vacuna. Y en realidad lo que se puede ver que hay una buena cantidad de anticuerpos anti-F inmunidad en la población general y que es resultado de la anual o semianual – cada dos años la infección siento que la mayoría de los adultos tienen. Por lo que todos dan infecciones por VRS en una base frecuente. A desarrollar la inmunidad muy robusto, pero el enigma aquí ha sido que la comunidad no está protegido y pero se puede ver aquí basado en el placebo que es común tener bastante robusto anti-F inmunidad en la población. Cuando nos vacunamos se puede ver que tenemos acerca de un aumento de cinco veces. Estos son de nuevo los adultos mayores – por lo que son más del 60 por lo que tienen la senescencia inmunitaria relativa y sin embargo nuestra vacuna está dando bastante robusta respuesta anti-F IDG.
Cuando nos fijamos en el palivizumab en el lugar de los dos que refleja el tipo de inmunidad que fue visto con el anticuerpo monoclonal. Una vez más, se puede ver las respuestas bastante robustos y éstas se situarían en niveles que consideramos debe estar en el rango protegido si refleja este tipo de eficacia observada con palivizumab. Una vez más respuestas muy robusto. Y lo que es interesante aquí es la gente a pesar de los hechos han tenido infecciones recurrentes, la línea azul en realidad está dibujado
en el límite de protección que significa que en la población general no hay casi ningún anticuerpo a este sitio conservado y creemos que eso ha sido una explicación importante por las razones que las personas con infecciones recurrentes de año en año – porque no tienen este tipo de la actividad que pensamos que es una característica crítica necesaria para la protección. Así que nuestra vacuna muestra el sitio induce inmunidad a ella y en contraste con la infección natural se debe, por tanto, protegida. Y esto es lo que vimos. Esta es una curva de Kaplan-Meier. Se puede ver el tiempo está en el eje X y el porcentaje de sujetos que no tienen RSV sobre desarrolló el tiempo – en primer lugar, lo que se determinó que aquí lo que es consistente con lo que vimos en la literatura es que tuvimos relativamente – tuvimos un 5% tasa global de infección por VRS que en el contexto de la vacuna es una muy alta tasa de ataque. Y se puede ver la divergencia de la población vacuna con el tiempo realmente persistir durante toda la temporada. Este es un efecto altamente significativo de la vacuna – por lo que la disminución de la tasa de infecciones por VRS.
Ahora, cuando nos fijamos en esto en términos de lo que podríamos tener en nuestros criterios de valoración se puede ver aquí ahora que teníamos una reducción del 40% en la infección por VRS de cualquier tipo, que creo que es un listón muy alto para la vacuna. Y luego nos fijamos en grupos de síntomas del tracto respiratorio inferior que vimos que la vacuna de eficacia fue alrededor del 64% y más que agrupan esto en términos de infecciones del tracto respiratorio inferior cuanto mayor es el efecto de la vacuna. Entonces, ¿cómo se compara esto con la vacuna Prevnar licencia que ha sido un gran éxito comercial desde un punto de vista de la salud pública – vacuna muy exitosa. Y se puede ver aquí en su ensayo de fase III que veían tipo de la barra del medio no es lo que su objetivo primario era reducir cepa de la vacuna relacionada confirmado la neumonía adquirida en la comunidad. Y vieron eficacia de la vacuna alrededor del 46%. Así que eso es lo que sus estados de la etiqueta de reclamación – prevención de la cepa de la vacuna comunidad confirmado la neumonía adquirida y que la eficacia está teniendo un gran impacto en la salud pública del neumococo.
Si nos fijamos en un resultado más grave, que es el objetivo secundario del ensayo – neumocócica invasiva – se puede volver a ver los aumentos de eficacia de vacunas a medida que suben en la severidad de la enfermedad. Por lo mucho que refleja nuestra experiencia desde cualquier RSV a los signos y síntomas más graves como se ve disminuciones de eficacia de vacunas. Ahora bien, si nos fijamos de nuevo en la mesa superior de estos dos hallazgos son ahora lo que hemos tenido en nuestros ensayos de fase III o puntos finales. En este hicimos nuestro criterio principal de valoración que refleja este tipo de resultados que se ven aquí y en este hemos hecho nuestro criterio de valoración secundario. Entonces, ¿qué estamos haciendo? Yo sé como se menciona en noviembre se matricularon 12.000 sujetos. Estas son las personas que tienen más de 60. Tienen – son fundamentalmente sana. Tienen enfermedad cardiopulmonar pero no están en el hospital. Y nuestro objetivo aquí – nuestro objetivo primario es prevenir el RSV de moderada a severa asociada infecciones del tracto respiratorio inferior como se define por estos sistemas múltiples vías respiratorias inferiores. La FDA nos hizo un gran favor al darle el apodo de moderada a severa infección por VRS. Así que estamos buscando para prevenir la infección moderada a severa por VRS. Todo ha sido – que fueron inmunizados en el marco de tiempo de Noviembre / Diciembre. Estamos pasando por una sola temporada. Se trata de 16 sitios en los EE.UU..
Entonces, ¿qué nos queda? Estamos a punto de terminar. Vigilancia terminará en mayo. Esperamos anunciar los datos en el marco de tiempo de tres cuartos. Eso nos permitirá luego presentar una BLA y se puede ver la Marcha para comprar estructura a través de la aprobación del FDA y luego lanzar. Así que vamos a también se convirtió rápidamente en el incienso. Así que aquí estamos tratando de proteger a los bebés a través de la inmunización de otros. Este es un mecanismo natural por el cual los niños – cuando nacen que han adquirido el repertorio completo de las respuestas inmunes – las respuestas de anticuerpos que la madre ha adquirido a través de la vida; para que estén protegidos durante los primeros meses de vida. El enigma aquí de nuevo como se ha mencionado a pesar de que tienen un nivel muy alto de RSV anticuerpos estos no son muy eficaces en la protección de los niños así que la enfermedad de pico en los bebés está en los primeros meses de vida, cuando en realidad están armados con los anticuerpos de la madre.
Así que lo que estamos haciendo es la inmunización de los demás. Ellos tienen el 100% de los anticuerpos de las madres. Se trata de un mecanismo en el que los anticuerpos se transfieren en realidad de la madre a los bebés por lo que es un mecanismo muy elegante utilizado por vacuna autorizada para la gripe y la tos ferina para prevenir esas enfermedades de los propios niños. Por supuesto, nosotros estamos buscando para ver la transferencia de estos anticuerpos palivizumab como en otras que son neutralizantes ampliamente. Así que hicimos un ensayo de Fase II. Reportamos resultados el pasado otoño. Realmente fue mucho acerca de la seguridad en los recién nacidos y las madres. Y en el estudio de la respuesta inmune en los niños y las madres y en busca de la transferencia de anticuerpos a los recién nacidos, ya que son nuestro objetivo principal lo que se puede ver aquí es la transferencia de anticuerpos de la placenta que tenemos una serie de medidas inmunes, incluyendo la respuesta a la vacuna y la proteína F. El palivizumab como anticuerpos – y estos son llamados anticuerpos neutralizantes. Lo que encontramos aquí es que se puede ver la transferencia bastante robusto. De hecho no hay concentración relativa de anticuerpo del bebé a la madre – o lo siento, de la madre con los bebés y por lo que terminan con aproximadamente un 20% más anticuerpos. Esto sólo es una diapositiva algo complicado en que encontramos que es coherente con la literatura que si hay tiempo suficiente para que los anticuerpos frente a (inaudible) – las madres inmunizadas que entregados 30 días después de la inmunización tenía transferencia de anticuerpos más robustos que los que eran esencialmente inmunizado y entregado a las pocas semanas de la inmunización.
Estas son respuestas robustas. Por ello deben protegerse y que son bastante optimistas de que ese será el caso en los bebés. Hay otra característica de aquí que tenemos en nuestra página web que es un poco complicado, pero estos son estos sitios de anticuerpos ampliamente neutralizantes. Este es un sitio palivizumab. Hay otros que se definieron hace mucho tiempo. Met inmunológico simplemente seleccionada para comercializar. Se espera que estos otros a tener la misma actividad. Y es la misma historia si nos fijamos en la población general – estos son los principales títulos de la media. Que en realidad flotan alrededor del límite de cuantificación – es decir, son muy, muy baja. Parecen estar escondido. Nuestra vacuna está solicitando respuestas de anticuerpos muy robustos y aquellos están siendo transferidos al bebé. Así que tenemos muchas razones para esperar que la vacuna debe ser eficaz basado en la ciencia y la experiencia histórica con estos anticuerpos. Por lo que el ensayo de fase II que habíamos muy bien tolerado vacuna. Es altamente purificada – esperas que. Tuvimos anticuerpo robusta transferidos a los bebés con alrededor de 120 niveles de anticuerpos% a aparecer en los recién nacidos. Y esperamos que para tener una vida media de, aproximadamente, 41 días y esperamos tener una protección muy robusta por lo menos durante un mínimo de 90 días que se refleja en nuestros criterios de valoración. Así que aquí comenzamos un ensayo de fase III. Es un juicio global, de modo RSV es una enfermedad global – es predecible epidemia en los lactantes y personas mayores y hemos ido -Hemos tomado ventaja de los factores en el hemisferio norte y el sur que está muy bien definido. Y aquí estamos mirando para prevenir la infección del tracto respiratorio inferior, medido por la hipoxemia, que es una medida oxímetro de pulso del bebé. Así que cuando tienen que dejar de enfermedad oxigenar bien y vamos a buscar que durante los primeros 90 días.
Se trata de PC son positivos por lo que este es activa y la vigilancia pasiva que está pasando. Haremos una variable secundaria que es una hipoxia más grave y también en busca de la vacuna contra el efecto a los seis meses. Se trata de un gran ensayo – juicio global. Está hecho de una manera secuencial grupo, que nos permite ajustar el tamaño de la base de juicio por el efecto de la vacuna que será evaluado de manera positiva por el DSMB independiente. Y hemos mencionado anteriormente esta es una de las principales prioridades en la base. Han tirado en $ 90 millones para apoyar este ensayo de fase III. Esto es realmente histórico. Tenemos un montón de emoción en nuestro mundo – nuestro pequeño mundo vacuna basada en este ensayo. Así que estas son razones que hemos tenido mucha confianza de seguir adelante. En primer lugar, hemos hecho un montón de trabajo en un modelo preclínico que fue predictivo de la eficacia de palivizumab en el campo, así que teníamos muchas cosas que ver en especial los niveles de anticuerpos y su efecto cualitativo. Así que hacemos muy pronto de que somos vacuna debe ser de protección. Luego vimos como nos fijamos en nuestros diferentes regímenes de dosificación y en las vacunas que tiene que en la Fase I y Fase II configuración que determinará la dosis y el esquema de dosis y – como secundaria también buscamos – estas personas pasaron por un RSV temporada. Vimos varias ocasiones que nos reducción de la infección en mujeres sanas en edad fértil.
Una vez más yo diría que un listón muy alto para la biología de la vacuna – efecto biológico. Así que nos dio confianza. Acabo de revisar para usted que hemos sido capaces de mostrar de una manera pre-especificado que podríamos prevenir la infección por VRS sintomática en adultos mayores y esta eficacia fue mayor frente a las variables más graves. Una vez más muy consistente con los hallazgos generales del campo de la vaccineologist. Y luego pensamos que estamos en muy buena forma con la transferencia de estos anticuerpos a los bebés en el entorno de la inmunización materna. Ha habido – esto no es nuevo. Ha habido una enorme cantidad de actividad debido a que la carga de la enfermedad y el tamaño del mercado es tan grande lo largo de muchos años. Ha habido muy pocos ensayos que permitan avanzar hacia fuera de la Fase I. Esta mucha actividad en la Fase I todavía. Tenemos – se puede ver que estamos en fase III y yo pensamos que somos varios años por delante de la competencia. GSK tiene un programa de inmunización materna y se reunió inmunológico tiene un programa de vacunación de adultos mayores que se encuentran de nuevo en la Fase II.
Esto sólo muy brevemente – es la influenza. Hemos demostrado los datos buenos en la configuración de la Fase II bajo nuestro contrato con BARDA para hacer tanto un cuarto Valent vacuna estacional y una vacuna pandémica que es lo que BARDA está principalmente interesado en ser capaz de responder a una nueva nueva cepa de la gripe que podría venir a través . Creemos que hay una gran oportunidad comercial para combinar las vacunas de RSV y la gripe en nuestra gestión de ciclo de vida. Estamos a la espera de entrar en un ensayo para demostrar esto. Creo que sería muy instructivo a pesar de que sería un ensayo de fase I potencial. Como hemos aprendido mucho acerca de RSV en nuestro ensayo de fase I que esperamos hacer lo mismo con nuestra vacuna respiratoria combinación.
Así que aquí está nuestro calendario – Fase III ensayo pivotal. Es un gran año para nosotros. Este será un resultado histórico en los adultos mayores. Que los datos estará en el tercer trimestre. También hemos hecho una prueba de refuerzo porque se trata de una vacuna anual de temporada, por lo que es importante mostrar su cara y tiene una respuesta inmune que está construido de forma que más de un año de la respuesta inmune a nuestra vacuna se debe esperar a decaer. Esto es en realidad un ensayo muy importante y luego esperar para iniciar el juicio en esta vacuna respiratoria combinación. En resumen, somos la única vacuna contra el VRS para demostrar protección. Tenemos dos candidatos III Fase. Tenemos una primera ventaja en el mercado de comercialización de los derechos globales y esta es una muy buena tecnología que tiene aplicaciones en muchas enfermedades. Creo que con eso tomaremos preguntas. Muchas gracias.
PREGUNTAS Y RESPUESTAS
llamada no identificada
(Inaccesibles micrófono)
Stan Erck
Construimos entonces una gran cantidad de espacio de maniobra. Así que esto ha sido lo que yo diría que es una temporada normal RSV. Lo que puede ayudarnos es que no ha sido una temporada de gripe normal por lo que si nos fijamos en el sitio web de los CDC se puede realizar un seguimiento de lo que sucedió con enfermedad de tipo gripal durante los dos primeros meses de nuestro período de vigilancia no había casi la gripe en los EE.UU.. Así que creo que nos ayudará. Sólo enriquece el PC son tasas positivas. Pero por lo demás parece un muy lo que diría temporada normal de RSV. Una vez más, se puede realizar un seguimiento de que en el CDC por lo que es un punto muy importante. Hemos estado como he mencionado al principio – Creo que hemos sabido esto por la historia que las tasas de ataque de RSV son muy predecibles y que es fundamental para la conducta en el ensayo. Por lo tanto somos capaces de pienso justificada teniendo esto en una sola temporada ensayo estadounidense basada en esa historia.
Construimos entonces – que accionó nuestro ensayo para nuestro criterio principal de valoración más del 90% en lo que potencia muy robusta de manera que nos permite disponer de margen de maniobra tanto en la estimación de la eficacia de la vacuna y la tasa de ataque.
NVAX. MTSL – Bioinvest 825
http://www.bioinvest.com/wp-content/uploads/2016/04/MTSL-Issue-825.pdf
Esta vez nada sobre NVAX salvo la mención del catalizador de Q3 y la actualización de nivel de cortos que desde la ultima carta empezaron a dar cobertura. Se ve que también les parece algo escandaloso, como a nosotros.
nvax
interesante. todo lo que sabemos pero es bueno recordar y saber la importancia de las cosas.
NVAX……………..
…………………………………………………………………………………………..
………………………………………………………………………………………………….
Nvax
Pues en el gráfico semanal se ve un comportamiento parecido en Mayo 2014 al actual.
Para ver los 8 en Mayo necesitamos algún catalizador que espero que venga el 20 de Abril por parte de Stan.
NVAX. venga, vengaaaaa esos 8 y pico que liquido ahi una buena pila de cromos y recompra en 6medios-altos. Vaaaamooooossssss
NVAX. «Surveillance will end in May» , que a mi entender significa que en Mayo la fase 3 quedara unblinded y lista para iniciar el analisis de resultados.
NVAX
Así es Framus, cada vez falta menos. Y todo acanza de manera imparable.
Me parece importante (además de lo que ha comentado Framus sobre que en mayo se abren los resultados de la fase 3 para elaborar las conclusiones del ensayo) este extracto de la conferencia de Needham sobre la gripe.
«This just very briefly — is influenza. We have shown nice data in the Phase II setting under our contract with BARDA to make both a quarter Valent seasonal vaccine and a pandemic vaccine which is what BARDA is primarily interested in being able to respond to a new novel strain of flu that might come through. We believe there is great commercial opportunity for combining the RSV and flu vaccines on our lifecycle management. We are expecting to get into a trial to show this. I think it would be very instructive even though it would be a potential Phase I trial. As we’ve learned so much about RSV in our Phase I trial we expect to do the same with our combination respiratory vaccine.»
«Brevemente sobre la gripe. Hemos demostrado bonitos datos en la fase II que entra dentro de nuestro contrato con Barda tanto en la cuadrivalente de temporada como en la pandémica (H7N9) que en la que Barda está principalmente interesada para poder responder con rapidez a la aparición de nuevas cepas.
Creemos que existe un enorme oportunidad comercial en la combinación del RSV y la gripe.
Esperamos empezar los ensayos (del combo) para demostrarlo. Creo que sería muy instructivo aunque sea un ensayo de fase I. Como hemos aprendido tanto sobre el RSV en la fase 1 esperamos hacer lo mismo con nuestra vacuna combinada respiratoria.»
Vamos a conocer datos sobre los programas de la gripe en breve. Yo creo que esta próxima semana. Pero las palabras de Glenn creo que demuestran (lo digo una vez más) la confianza que tiene la gente de Novavax en su vacuna de la gripe. Sin esta vacuna de la gripe, lo recuerdo, no hay combo posible.
Este año Novavax va a hacer historia. No me cabe ninguna duda.
Nvax
Y esto…»Vamos a desarrollar la vacuna contra el VRS por primera vez en los ancianos y llevarlo al mercado en los EE.UU. y el plan de asociarse fuera de los EE.UU. con las «COMPAÑIAS DE VACUDAS GLOVALES»»
NVAX
Así es ÑAKO, compañías globales, no pequeñas Farmas regionales.
Eso abre la posibilidad a un Partner que luego pueda adquirir a Novavax.
Yo apuesto por una americana…..
NVAX
Interesante documental de Sábado :El negocio de las farmacéuticas
https://www.youtube.com/watch?v=Vku8q_KAH-M
NVAX. Pat, cada vez que leo una transcripción de una conferencia, cada vez que leo a Stan o a Glenn … joer, me dan ganas de quedarme de cerrar los ojos y quedarme comprado con toda la carga hasta que den los resultados … eso que llamáis algunos … hacer un salto de fé … a ver si se me pasa, leñe …
a ver si se me pasa, leñe …
Nvax… Para Framus….Las “las reglas están para romperlas”. Eso se dice, al menos, y la verdad es que me parece una aserción mucho más saludable que su antítesis: “la ley está para cumplirla”. Esta segunda idea tiene su lógica: si no cumpliéramos las leyes, viviríamos inmersos en el caos. Pero con frecuencia olvidamos la primera aserción: si no rompemos nunca las normas, entonces tardará mucho más en cambiar, incluidas las leyes injustas o periclitadas, ..
..no se sí esto te ayudara jejeje ,bueno, hagas lo que hagas , seguro que aciertas , los Don/es no entienden de leyes .
NVAX. ja,ja Jesús, me faltan agallas … por no decir una palabra mas florida del diccionario de Cervantes. Si me quede dentro a las fases 2 es porque estadisticamente son mucho mas asequibles en todos los sentidos.
Todo depende de lo generoso que sea el mercado pre-news …
NVAX. Digo que depende de lo generoso que sea el mercado pre-news porque el año pasado llegamos a los 13$ en dos ocasiones con motivo de la fase 1 del Ebola y de la fase 2 de la gripe. Tuvimos ahí un mvto de de 10 a 13 , vuelta a 11 y vuelta a 13 de nuevo, todo ello en cosa de 1 mes , primeros de Julio-primeros de Agosto.
De esos 13$ a los 15,01 apenas hay un 15-16% de premium si te quedas a ver desde dentro la fase 2 del RSV ancianos. Evidentemente el mercado ya habia descontado exito en todo en esos 13$ y el +15% extra fue vicio, pasión y euforia del momento.
Así que veamos lo que nos da esta vez el mercado, veamos hasta donde llega y descuenta, si es que estamos en un mercado que aun descuenta por adelantado, cosa que no estoy viendo en absoluto en ninguno de los valores que llevo observando hasta la fecha salvo en aquellos que se enfrentan a aprobaciones para ir a mercado.
En fin, paso a paso …
Nvax.. Bueno , al igual que rentabilidades pasadas no garantizan rentabilidades futuras , esperemos que movimientos pasados sean sólo eso y definitivamente despegue como tantas otras pharmas y que a día de hoy son potentes industrias .
Pero entiendo el sentido racional que indicas .
Nvax
Gracias por compartir la conferencia. dan ganas de invertir hasta lo que me queda en el fondo de las tazas junto a los clips y demás joyas, pero prefiero seguir con cierta cautela y a pesar de mi confianza en lo que se puede conseguir preferiría no quedarme con todo cuando presenten resultados… A ver como estamos en 3 meses y ya veremos…
NVAX
La reunión de Doha termina sin acuerdo entre los grandes productores de petróleo
Arabia Saudí ha roto finalmente las negociaciones y ha instado a Irán a cumplir también el acuerdo de los demás países
A ver lo divertido que resulta el lunes!
Nvax
Buenos días, artículo donde nos nombran por el tema cortos…
http://feedproxy.google.com/~r/typepad/RyNm/~3/dMH_0menmPI/
Saludos
NVAX. Buenas, tras el batacazo inicial en los futuros por el tema del crudo y verlo en un -6% y los futuros en -0,6% … hemos pasado a -2,5% y 0,2% respectivamente, remotando antes de apertura. Incluso el IBEX recuperando un punto entero desde apertura …. ummmm ….
NVAX
Cotización aburrida,abuuuurridisia,NO HAY MAS.
https://www.youtube.com/watch?v=if5vMPDxxEE
NVAX………Prueba de video….
https://www.youtube.com/watch?v=Qsc40u4kHGo
…………………………………………………………………………………………………………….
……………………………………………………………………………………………………………..
NVAX.- Como molan así los videos!!!! Menuda actualización le esta metiendo a esto Super!!!
NVAX-Què pasada el video..
Nvax
Súper yo solo,puedo ver el vídeo abriendo YouTube. Cuando lo intento ver en su mensaje no me lo abre y me indica que «se ha producido un error»
NVAX
Súper a mi me sale un mensaje de error y que lo intente más tarde. Mas tarde me dice lo mismo.
NVAX.-
Gracias por el vídeo Super. Me ha encantado.
Hace unos días tuve ocasión de ver un vídeo extraído la serie Cosmos, de Carl Sagan, y éste que ha colgado hoy, me lo ha traído a la memoria…
Aquí os lo dejo. Merece la pena que lo veáis.
https://www.youtube.com/watch?v=F3eH_twjIS8
Saludos a todos.